線スペクトル

実験番号:UE5020100
原子の発するスペクトルは,各原子ごとに特有の系列を持っています。その系列は原子番号が大きくなるほど,複雑になっていきます。反対に水素原子の可視光領域のスペクトルは,単純なボーアの原子モデルで説明できます。
実験の手順
- 水素の線スペクトルを観察します。
- バルマー系列のHα,Hβ,Hγ,Hδの周波数を測定します。
- リュードベリ定数を計算します。
- 不活性ガスと金属蒸気の線スペクトルを観察します。
実験に必要な機器
- U17310:分光器・S型 ×1
- U418001-115:スペクトル管電源,保護フェンス付 ×1
- U41817:スペクトル管・水素(H) ×1
- U13261:万能クランプ ×1
- U15002:ステンレス鋼製支柱・47cm ×1
- U13255:角型ムッフ ×1
- U13265:支柱用台座 ×1
更に進んだ実験のためには,以下のスペクトル管をお勧めいたします
- U41816:スペクトル管,ヘリウム(He)
- U41821:スペクトル管,ネオン(Ne)
- U41811:スペクトル管,アルゴン(Ar)
- U41819:スペクトル管,クリプトン(Kr)
- U41820:スペクトル管,水銀(Hg)
実験解説書
英語版 実験手順書 ダウンロード(参考,一部取り扱いのない製品も含まれています)
基本原理
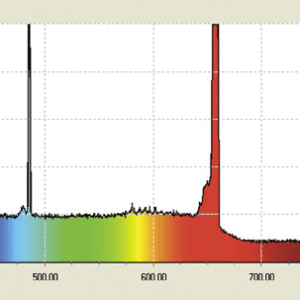
励起状態にある原子は,その原子に特有の線スペクトルを発生します。この線スペクトルは,電子のエネルギー準位間遷移により発生するので,原子の電子軌道構造によります。水素原子の可視光領域での線スペクトルは,Hα,Hβ,Hγ,Hδの4本があります。紫外領域まで計測すると,更に線スペクトルがあることが分かります。1885 年にバルマーが,このスペクトル系列を次の単純な式で表すことができるのを発見しました。
(1)
ここでn は3 以上の自然数で,R はリュードベリ定数です。後になってこの式は,ボーアの原子モデルにより説明できることが分かりました。電子がエネルギーの高い準位から低い準位(バルマー系列の場合,基底状態の一つ上の準位)へ遷移するときに,エネルギー差に相当する光を発するというものです。
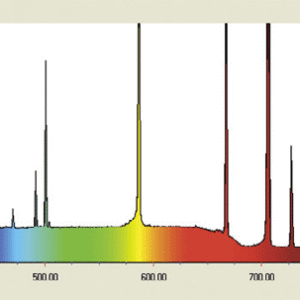
ヘリウム原子の場合,水素に電子がもう一つ増えただけですが,非常に複雑になります。その理由として電子のスピンが挙げられます。スピンの向きが平行か反平行かという違いにより,エネルギー準位が変わってくるためです。
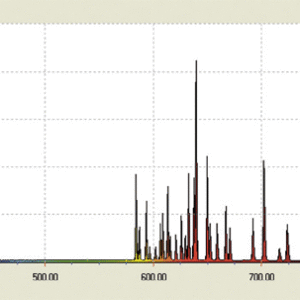
こうした複雑さは,原子番号が大きくなるに連れて更に増大します。しかしいずれにしてもスペクトル系列は,各原子に固有の系列となります。
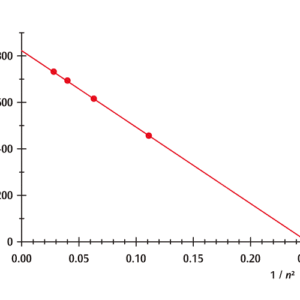
バルマー系列の周波数νを![]() を横軸にプロットすると,直線に乗ることが分かります。この直線の傾きがリュードベリ定数になります。またx 軸との交点がx=0.25 であることより,バルマー系列はn=2 のエネルギー準位への遷移によるものであることが分かります。
を横軸にプロットすると,直線に乗ることが分かります。この直線の傾きがリュードベリ定数になります。またx 軸との交点がx=0.25 であることより,バルマー系列はn=2 のエネルギー準位への遷移によるものであることが分かります。
参考資料
-
図1:1/n2を横軸にしたバルマー系列の遷移周波数
-
図2:水素原子の線スペクトル
-
図3:ヘリウムの線スペクトル
-
図4:ネオンの線スペクトル
-
図5:水銀蒸気の線スペクトル